Optische Emissionsspektren kann man erzielen, indem man Atome von außen mit einer Energie von einigen eV anregt. Bei Mehrelektronensystemen regt man dabei Elektronen des Atoms an, die schon auf Niveaus mit einer höheren Hauptquantenzahl sitzen (bei Natrium regt man z.B. das 3s-Elektron an).
Will man bei höheren Atomen Elektronen aus den tieferliegenden Niveaus (z.B. n = 1) anregen, so braucht man mehr Energie. Schon die einfache bohrsche Theorie (die natürlich auf höhere Atome nicht anwendbar ist) besagt, dass für die Energie im n-ten Quantenzustand gilt:
\[{E_{{\rm{ges}}{\rm{,n}}}} = - {Z^2} \cdot 13,6 \cdot \frac{1}{{{n^2}}}{\rm{eV}}\]
Die Kernladungszahl \(Z\) (die bei höheren Atomen wohl durch eine korrigierte Kernladungszahl \(Z_{\rm{eff}}\) zu ersetzen ist) geht beim Energieterm quadratisch ein, was dazu führt, dass der energetische Abstand der niederen Niveaus bei Atomen höherer Ordnungszahl im keV-Bereich liegt. Die dazugehörigen Übergänge liegen dann im Röntgenbereich.
Bei der Anregung von "inneren" Elektronen und "äußeren" Elektronen besteht neben dem verschiedenen Energiebereich noch ein anderer wesentlicher Unterschied:
Ein "äußeres" Elektron hat in seiner energetischen Nachbarschaft stets freie Niveaus, auf die es angehoben werden kann. Dies ist für die "inneren" Elektronen der Atome höherer Ordnungszahl nicht der Fall, da bei genügend hohem \(Z\) bereits alle tieferen Niveaus besetzt sind. Will man z.B. ein Elektron aus einem Niveau mit \(n=1\) anregen, so muss man es auf das erste noch unbesetzte Niveau heben und dies kann schon sehr nahe an der Ionisierungsgrenze liegen.
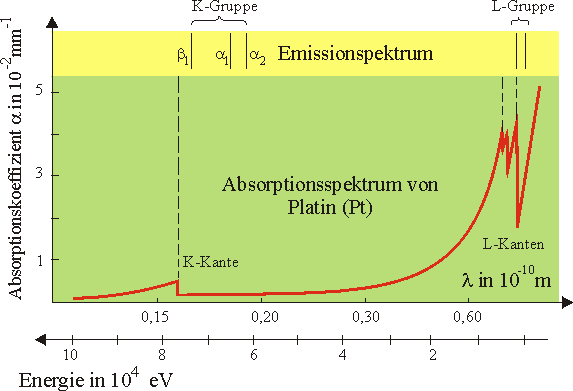
Röntgenabsorptionsspektrum
Am besten sieht man die Verhältnisse, wenn man das Röntgenabsorptionsspektrum für ein Atom höherer Ordnungszahl betrachtet. In der folgenden Abbildung ist das Absorptionsspektrum von Platin mit \(Z=78\) dargestellt. Man gewinnt es, indem man eine Platinfolie mit Röntgenstrahlung verschiedener Wellenlänge durchstrahlt und jeweils die Intensität der durchgelassenen Strahlung registriert (z.B. mit einem Film). Ist die Intensität der durchgelassenen Strahlung gering, so ist der Absorptionskoeffizient a von Platin groß.
Ergebnisse (verallgemeinert)
- Röntgenabsorptionsspektren sind im Gegensatz zu optischen Absorptionsspektren keine Linienspektren, sondern weitgehend kontinuierlich.
- An den sogenannten Absorptionskanten steigt der Absorptionskoeffizient sprunghaft an, um dann zu hohen Energien kontinuierlich abzunehmen.
- Bei den optischen Spektren fallen die Emissions- und Absorptionslinien energetisch zusammen. Bei den Röntgenspektren liegt die jeweilige Absorptionskante energetisch höher als die zugehörigen Emissionslinien.
Erklärung der Röntgenabsorption
Man kann das Röntgenabsorptionsspektrum recht gut verstehen, wenn man von einem Schalenmodell des Atoms ausgeht und sich das obige komplexe Absorptionsspektrum in verschiedene Teilspektren zerlegt denkt. In das unten skizzierte Absorptionsspektrum sind bereits (stark vereinfachte) Termschemata des Platins an verschiedenen Stellen eingezeichnet. Dabei ist für die L- und M-Schale bereits eine Feinstruktur vorgegeben.
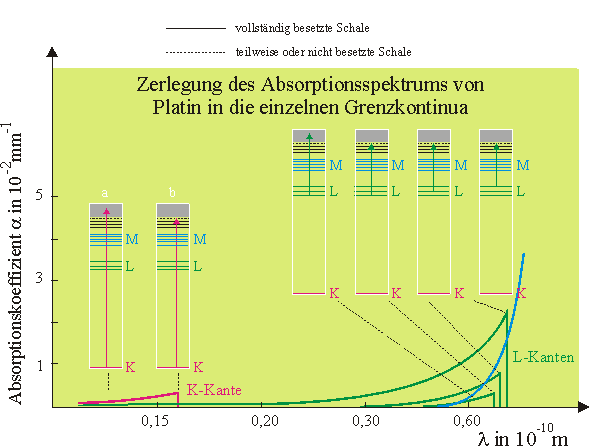
Betrachtung des violetten Anteils des Absorptionsspektrums
Röntgenphotonen deren Wellenlängen rechts von der K-Kante liegen, haben eine zu geringe Energie um K-Elektronen auf ein noch unbesetztes Niveau heben zu können, sie gelangen nahezu ohne Absorption durch das Platinblech.
Bei Energiesteigerung der Photonen ist schlagartig eine Anregung der K-Elektronen möglich, die Photonen werden absorbiert, der Absorptionskoeffizient steigt sprunghaft an (Fall b).
Steigert man die Photonenenergie weiter, so ist sogar eine Anregung der K-Elektronen bis ins Kontinuum möglich und als Folge ergibt sich ein kontinuierliches Absorptionsspektrum (Fall a). Mit zunehmender Energie sinkt offensichtlich die Wahrscheinlichkeit für die Absorption, was daran liegt, dass der Wirkungsquerschnitt für den Photoeffekt, der bei dieser Absorption der entscheidende Prozess ist, mit zunehmender Photonenenergie sinkt.
Betrachtung des grünen Anteils des Absorptionsspektrums
Es gelten die gleichen Überlegungen wie für die Anregung aus der K-Schale, jedoch erfolgt hier die Anregung von L-Elektronen, die energetisch nicht so weit von der Ionisierungsgrenze entfernt sind. Daher liegen die L-Kanten energetisch niedriger als die K-Kante. Da auf der L-Schale mehr Elektronen sitzen als auf der K-Schale ist die Absorptionswahrscheinlichkeit und somit der Absorptionskoeffizient höher.
Aus dem deutlichen energetischen Abstand der Absorptionskanten kann man auf den deutlichen energetischen Abstand der Schalen im Atom schließen (vergleichen Sie hierzu die entsprechenden Musteraufgaben).
Röntgenemissionsspektrum
Wenn durch Absorption Lücken auf den Schalen mit niedriger Hauptquantenzahl entstanden sind, werden diese von Elektronen aus höheren Schalen wieder aufgefüllt. Dabei kommt es zur Emission der für das jeweilige Material charakteristischen Röntgenlinien, deren Quantenenergie stets niedriger ist als die entsprechende Kante. Eine passende Animation zur Emission findest du auf der folgenden Grundwissens-Seite.
Hinweis:
Im Termschema in Abb. 4 ist die Feinstruktur der Schalen nicht berücksichtigt.



