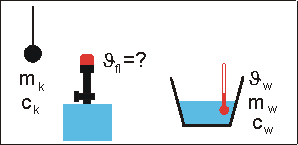Versuchsaufbau und -durchführung
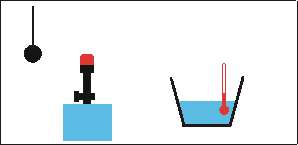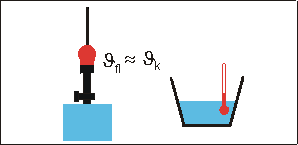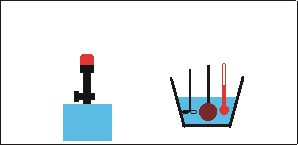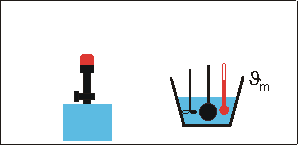
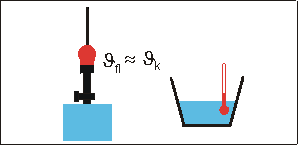
Zur Abschätzung der Flammentemperatur bringt man eine Metallkugel (Masse mk, spezifische Wärmekapazität ck) in die Flamme. Nach kurzer Zeit hat die Kugel die Temperatur der Flamme angenommen (Metalle sind gute Wärmeleiter).
Dann bringt man die glühende Kugel schnell in ein Wasserbad (Wassermasse mw, Wassertemperatur ϑw, spezifische Wärmekapazität cw) und stellt nach dem Umrühren die Mischtemperatur ϑm fest.
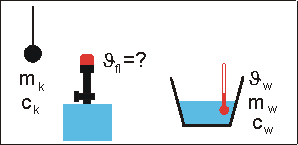
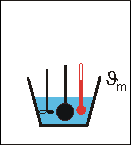
Versuchsauswertung
Nach dem Energieerhaltungssatz gilt
\[\Delta {E_{{\rm{i}}{\rm{,ab}}}} = \Delta {E_{{\rm{i}}{\rm{,auf}}}} \Leftrightarrow {m_{\rm{K}}} \cdot {c_{\rm{K}}} \cdot \left( {{\vartheta _{\rm{K}}} - {\vartheta _{\rm{M}}}} \right) = {m_{\rm{W}}} \cdot {c_{\rm{W}}} \cdot \left( {{\vartheta _{\rm{M}}} - {\vartheta _{\rm{W}}}} \right) \Leftrightarrow {\vartheta _{\rm{K}}} - {\vartheta _{\rm{M}}} = \frac{{{m_{\rm{W}}} \cdot {c_{\rm{W}}} \cdot \left( {{\vartheta _{\rm{M}}} - {\vartheta _{\rm{W}}}} \right)}}{{{m_{\rm{K}}} \cdot {c_{\rm{K}}}}} \Leftrightarrow {\vartheta _{\rm{K}}} = \frac{{{m_{\rm{W}}} \cdot {c_{\rm{W}}} \cdot \left( {{\vartheta _{\rm{M}}} - {\vartheta _{\rm{W}}}} \right)}}{{{m_{\rm{K}}} \cdot {c_{\rm{K}}}}} + {\vartheta _{\rm{M}}}\]
Beispiel: \({m_{\rm{K}}} = 30,6{\rm{g}}\), \({c_{\rm{K}}} = 0,46\frac{{\rm{J}}}{{{\rm{g}} \cdot {\rm{^\circ C}}}}\), \(300{\rm{g}}\), \({{\vartheta _{\rm{W}}} = 17,2^\circ {\rm{C}}}\), \({c_{\rm{W}}} = 4,19\frac{{\rm{J}}}{{{\rm{g}} \cdot {\rm{^\circ C}}}}\) und \({{\vartheta _{\rm{M}}} = 30,0^\circ {\rm{C}}}\). Dann ergibt sich für \({{\vartheta _{\rm{K}}}}\)
\[{\vartheta _{\rm{K}}} = \frac{{300{\rm{g}} \cdot 4,19\frac{{\rm{J}}}{{{\rm{g}} \cdot {\rm{^\circ C}}}} \cdot \left( {30,0^\circ {\rm{C}} - 17,2^\circ {\rm{C}}} \right)}}{{30,6{\rm{g}} \cdot 0,46\frac{{\rm{J}}}{{{\rm{g}} \cdot {\rm{^\circ C}}}}}} + 30,0^\circ {\rm{C}} = 1,2 \cdot {10^3}^\circ {\rm{C}}\]
Da die Flammentemperatur ungefähr gleich der Temperatur der Kugel vor dem Mischen ist, kann man sagen, dass die Flamme etwas über \({1000^\circ {\rm{C}}}\) heiß ist.