nach Ausführungen von Dr. Bergold und Prof. Sexl
- Geschichtlicher Überblick über die Entwicklung des Begriffs "Wärme".
- Zum Schmunzeln ist ein Rückruf auf die Kalorie vom unvergessenen Prof. R. Sexl angefügt.
- Zur Terminologie der Begriffe in der Wärmelehre folgt ein Beitrag von Dr. Bergold, von dem auch der Rückblick auf das Caloricum stammt.
Rückblick auf das frühere Vorgehen im Physikunterricht
Früher hat man die "Wärmemenge" zunächst als Grundgröße (ΔQ) mit der Einheit Kilokalorie eingeführt. Das Grund-Messverfahren war ein Mischungsversuch und später zunehmend der Erwärmungsversuch mit dem Tauchsieder (ohne die elektrische Arbeit zu messen; es musste jedesmal "der gleiche" Tauchsieder sein, was immer das bedeuten mochte). Den Abschluss bildete die Bestimmung des "mechanischen Wärme-Äquivalents" z.B. mit der Schürholzkurbel. Dieser Weg ist im Wesentlichen der historische. Der Erhaltungssatz für die Wärmemenge wurde lange Zeit getrennt von dem Erhaltungssatz für die mechanische Energie gesehen. Rumford bahnte mit seinen Experimenten beim Kanonenbohren (vgl. Modell im Deutschen Museum, Abt. Wärmelehre) eine Vereinigung der beiden Sätze an. Robert Mayer sah den Zusammenhang klar (Gedankenversuch zu den spezifischen Wärmen der Gase) und Joule untermauerte ihn experimentell.
Wir haben heute keinen Anlass, den historischen Weg didaktisch nachzugehen. Wesentlich ist dabei nicht so sehr, dass die Kalorie seit dem 1. 1. 1978 nicht mehr als Einheit zugelassen ist (vgl. Sexl: Abschied von der Kalorie). Wichtiger ist, dass wir die Energie von vorneherein als umfassende Erhaltungsgröße im Blick haben und dort, wo sie nicht erhalten zu sein scheint, sofort nach dem Effekt suchen, hinter dem sich der Fehl- oder Überschussbetrag verbergen könnte. Die Experimente zur Energieerhaltung sind geblieben, nur ihre Reihenfolge hat sich geändert und ihre Interpretation. So kann man auf die Mischungsversuche nicht verzichten. Denn die Vorstellung, die Energie sei bei der Reibung ohne Verlust in den erwärmten Körper geflossen, wäre ohne jeden Erkenntniswert, wenn man diese innere Energie niemals wiederbekommen könnte oder wenn sie bei der Abkühlung des Körpers auf die ursprüngliche Temperatur nicht vollständig wieder herauskäme. In der Fachsprache ausgedrückt: Es muss wenigstens an Beispielen geprüft werden, ob die innere Energie eine Zustandsgröße ist. Nun kühlen sich Körper nur durch Berührung mit kälteren ab. Die Reibung lässt sich leider nicht umkehren. Daher macht man Mischungsversuche.
Roman Sexl: Abschied von der Kalorie (aus einer Tischrede anlässlich einer Verlagsfeier)
Wenn ich hier das Wort ergreife, so darum, um in einigen ergreifenden Worten Abschied von einer alten Bekannten zu nehmen. Es ist die Kalorie, die in unseren Kreisen auch unter den Pseudonymen der Kilokalorie oder der internationalen Tafelkalorie bekannt wurde. Grausam wurde sie ermordet, unsere alte Bekannte, durch die Bestimmungen des Gesetzes über Einheiten im Messwesen., das sie ebenso dahinraffte wie einige andere Lieblingsschauspieler der internationalen Schulbuchszene. Müssen wir uns doch auch vom Kilogramm-Meter, dem Gauss und vielen anderen Begleitern unseres bisherigen physikalischen Lebens verabschieden.
Mit der Kalorie stirbt auch die Erinnerung an das Kalorikum, den Wärmestoff, dahin, und dieses Dahinscheiden ist vielleicht am charakteristischsten für die Entstofflichung, ja geradezu Entmaterialisierung der Physik, die durch die Radkialinskis der Eichämter verursacht wurde.
Man hat der Kalorie viel nachgesagt in ihrem langen Leben. Vor allem, dass sie dick macht, woran ihr Spitzname Kilo-Kalorie erinnern sollte. Ich selbst ziehe die Bezeichnung "Internationale Tafelkalorie" bei weitem vor, die zumindest an die damit verbundenen Tafelfreuden erinnert. Allerdings haben in den letzten Jahren viele Ärzte herausgefunden, dass Kalorien eigentlich gar nicht dick machen. Vom wissenschaftlichen Standpunkt der Physik ist dies sehr einfach zu zeigen. Betrachten Sie nur die berühmte einsteinsche Relation E = m× c2. Mit ihr können wir einfach das Massenäquivalent einer Kalorie berechnen und finden, dass ihr nur 5× 10-11 Gramm entsprechen. Um 1 Kilogramm zuzunehmen, muss man daher 20 Billionen Kilokalorien zu sich nehmen. Wahrhaft falsch war daher der Verdacht, dass Kalorien dick machen.
In unserer Trauer um die Dahingeschiedene verbleibt vielleicht der Trost: ihr Nachfolger Joule, ist zumindest nach einem Bierbrauer aus Manchester benannt, und so bleibt die Erinnerung an energetische Tafelfreuden auch hier erhalten. Dennoch ist die Kalorie unersetzlich. Unersetzlich in doppelter Hinsicht.
Erinnern wir uns doch nur der schönen Schulbuchverse von der Beschwörung der Kalorie. Wie geheimnisvoll klang das doch: Man nehme 1 Kilogramm Wasser, normalen Luftdruck und erhitze langsam von 14,5 auf 15,5 Grad. An die geheimnisvollen Rezepte der Druiden erinnerte diese Vorschrift, welche die internationale Kalorie sorgfältig von ihren minderwertigen Konkurrentinnen, mittleren und anderen schrecklichen Kalorien unterschied. Das Schulbuchwissen für zukünftige Direktoren von Eichämtern geht hier verloren, wenn die Beschwörung der Kalorie unter Absingung heiliger Gesänge bei Mondschein um Mitternacht in Hinkunft nicht mehr Lehrstoff sein wird.
Der Abschied von der Kalorie ist aber ein doppelter Verlust. Nicht nur geliebten Prüfungsstoff werden wir in Hinkunft vermissen, auch die letzten romantischen Winkel unserer Wissenschaft gehen verloren und die Physik wird wieder um einen Schritt entmythologisiert. und ihrer Reize beraubt. Wie schön und unübersichtlich war es doch bisher, Kilokalorien oder Joule oder Kilowattstunden oder PS verwenden zu dürfen. Transparenz heißt das neue Schlagwort sowohl in Politik als auch in Physik.
Wie unromantisch wird unser Leben, wenn wir z.B. fragen wie viel Kilowattstunden unser Festmahl hier aufweist? Eine ganze Kilowattstunde wurde uns hier serviert, und ungefähr zwanzig Pfennig an Energie ist unsere Ernährung dem verehrten Verlage wert. Wenn uns aber andererseits der Verlagsdirektor fragte, "was haben Sie geleistet", so können wir antworten: etwa eine Kilowattstunde täglich! Folglich - so schließt der Verlag messerscharf, ist unsere Arbeit bei Berücksichtigung der 5-Tage-Woche etwa eine Mark wöchentlich wert.
Der Verlust der Romantik der Kalorie verführt aber auch auf anderen Gebieten zu grauenhafter Transparenz. Ist es günstiger, Taschenlampenbatterien oder Kaviar zu essen? Taschenlampenbatterien sind deutlich vorzuziehen, kosten sie doch nur etwa 800 DM pro Kilowattstunde, während Kaviar heute den stolzen Preis von 1000 DM pro Kilowattstunde, kostet. Sogar unser tägliches Brot kostet etwa 3 DM für ein Kilowattstunde, und so wissen wir erst voll die Leistungen der Elektrizitätswerke zu schätzen, deren tägliche Kilowattstunde, von allen atomaren Beimengungen fanatisch gereinigt, wir stets um 20 Pfennig genießen dürfen.
So trauern wir um dich, geliebte Kalorie, Verschleierin aller Zusammenhänge, und heben unser 100-Watt-Glas zu Deinem Gedenken.
Zur Terminologie
Im Lehrplan (gemeint ist der von 1977) wie im vorstehenden Text wurden mit Bedacht die Wörter Wärme und Wärmeenergie vermieden. "Erwärmung" wird stets als Synonym für "Temperaturerhöhung" gebraucht. Die innere Energie insgesamt als Wärmeenergie zu bezeichnen, wie es ab und zu in der Literatur geschieht, ist nicht sinnvoll. Denn man kann sie manchmal verändern, ohne dass dies mit Erwärmung oder Abkühlung verbunden wäre (Verdampfen, Schmelzen, chem. Umsetzung).
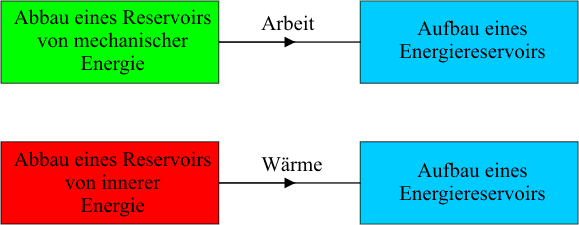
Anders ist es mit der Wärme als Übergangsgröße. Die Thermodynamik unterscheidet zwischen zwei Arten der Wechselwirkung von Systemen, der thermischen - allein aufgrund der ungeordneten Teilchenbewegung, ohne makroskopischen "Mechanismus" - und der nichtthermischen. Die bei thermischer Wechselwirkung übergehende Energie heißt Wärme, alle auf nichtthermische Art übergehende Energie heißt Arbeit. Diese Unterscheidung ist für die eigentliche Thermodynamik, d.h. die mit dem 2. Hauptsatz zusammenhängenden Aussagen, wesentlich, dagegen für das Verständnis des Energiesatzes unerheblich. Sie lenkt hier sogar eher vom Wesentlichen ab. Denn für die Energieerhaltung kommt es ja gerade nicht darauf an, wie die Systeme wechselwirken; im abgeschlossenen System bleibt die Energie allemal konstant.
Natürlich ist es nützlich, für bestimmte Arten der Wechselwirkung Maßgrößen zu besitzen, die den Energieumsatz zu berechnen gestatten, z.B. Kraft und Weg bei der mechanischen Wechselwirkung. Im Lehrplan wird der Energiebegriff sogar über diese Größen eingeführt.
Der Schüler gewinnt nichts für seine Vorstellung von Energie, wenn er die Energieübergänge scharf zu klassifizieren lernt. Dagegen muss er wissen, wo er in einem gegebenen System die Energie zu suchen hat, aus welchen Parametern und mit welchen Funktionen sie sich berechnen lässt. Aus diesen Gründen verzichtet der Lehrplan der Mittelstufe auf die Definition des Terminus "Wärme". Die Bezeichnungen Wärmekapazität und spezifische Wärmekapazität sind unglücklich, aber sie sind allgemein eingeführt und daher nicht zu umgehen. Der Lehrplan unterscheidet dagegen bei der gespeicherten Energie die Formen innere, kinetische und Höhenenergie.
Zur Geschichte
Lange Zeit hatte man geglaubt, Wärme sei ein Stoff, der weder erzeugt noch vernichtet werden kann. Diesen Stoff nannte man "Caloricum". Beim Erwärmen ging nach dieser Auffassung Caloricum vom heißen Körper auf den kalten über. Viele Erscheinungen ließen sich mit dieser Hypothese befriedigend erklären, und so kam es, dass noch um 1800 die Wärmestofftheorie fast allgemein anerkannt war.
Eigenschaften, die dem Caloricum zugeschrieben wurden:
- Das Caloricum ist eine elastische Flüssigkeit, ein Fluidum, dessen Teilchen sich gegenseitig abstoßen, während sie gleichzeitig von den Teilchen der gewöhnlichen ponderablen (wägbaren) Materie angezogen werden, wobei die Anziehungskraft von der Qualität der Materie und deren Aggregatzustand abhängig ist.
- Man kann dieses Fluidum weder vernichten noch erzeugen; es genügt einem Erhaltungssatz wie auch der ponderable Stoff.
- In den ponderablen Stoffen kann das Caloricum sowohl messbar als auch latent vorhanden sein. Im zweiten Fall bildet die Wärmesubstanz gewissermaßen eine chemische Verbindung mit dem ponderablen Stoff.
- Keine einheitliche Meinung existierte über das Gewicht der Wärmesubstanz. Von positiver Masse über gewichtslos bis hin zu negativer Masse gingen die Vorstellungen.
Im Jahre 1796 veröffentlichte Benjamin Tompson, besser bekannt als bayrischer Graf Rumford (ein Titel, den er sich als langjähriger Berater des bayr. Kurfürsten erworben hatte), eine "Untersuchung über den Ursprung der Wärme, die durch Reibung erzeugt wird". In dieser Arbeit wies er darauf hin, dass Kanonenrohre beim Ausbohren sehr heiß werden und dass der dabei erzeugten Wärme keine Grenzen gesetzt sind. Weil dieser Sachverhalt mit der Stofftheorie in krassem Widerspruch steht, kam Rumford zu dem Schluss, dass Wärme viel wahrscheinlicher "eine Art Bewegung" sein dürfte.

