Vorbemerkung
Das Strontium-Isotop \({}^{90}{\rm{Sr}}\) ist ein künstlich hergestelltes radioaktives Isotop mit einer Halbwertszeit von \(28{,}5\,\rm{a}\). \({}^{90}{\rm{Sr}}\) zerfällt durch Beta-Zerfall unter Emission eines Elektrons mit maximal \(546\,\rm{keV}\) in das radioaktive Yttrium-Isotop \({}^{90}{\rm{Y}}\). \({}^{90}{\rm{Y}}\) zerfällt wiederum durch Beta-Zerfall mit einer Halbwertszeit von \(64{,}1\,\rm{h}\) Stunden unter Emission eines Elektrons mit maximal \(2274\,\rm{keV}\) zum stabilen Zirkonium-Isotop \({}^{90}{\rm{Zr}}\).
Die energiearmen \(\beta\)-Teilchen des Zerfalls von \({}^{90}{\rm{Sr}}\) in \({}^{90}{\rm{Y}}\) werden allerdings in der Abdeckung des Präparates vollständig absorbiert, daher treten nur die energiereichen \(\beta\)-Teilchen des Zerfalls von \({}^{90}{\rm{Y}}\) in \({}^{90}{\rm{Zr}}\).
Aufbau und Durchführung
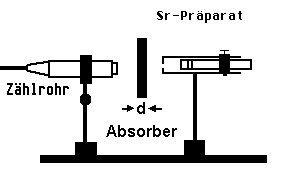


Man untersucht die Zählrate (Torzeit z.B. 100s; um Nullrate bereinigt) in Abhängigkeit von der Dicke d des Absorbers.
Beobachtung
| Dicke \(d\;{\rm{in}}\;{\rm{mm}}\) | \(0{,}0\) | \(0{,}2\) | \(0{,}5\) | \(0{,}7\) | \(1{,}0\) | \(1{,}2\) | \(1{,}5\) | \(1{,}7\) | \(2{,}0\) |
|---|---|---|---|---|---|---|---|---|---|
| Zählrate \(R\;{\rm{in}}\;\frac{{\rm{1}}}{{\rm{s}}}\) | \(127{,}2\) | \(81{,}5\) | \(51{,}2\) | \(39{,}9\) | \(27{,}4\) | \(19{,}7\) | \(13{,}8\) | \(8{,}0\) | \(3{,}9\) |
Auswertung
Aufgabe
Trage die Ergebnisse in einfach logarithmischem Papier auf oder bearbeite das Ergebnis mit einem Tabellenkalkulationsprogramm (z.B. Excel) entsprechend.
Bestimme die Steigung, die Halbwertsdicke und den Absorptionskoeffizienten \(\alpha\).

