Hinweis: Diese Seite setzt Chemie-Kenntnisse voraus. Wenn du nicht gerade eine Chemie-Freak bist, werden dir diese fehlen. Aber auch wenn du nur den Text durchliest, bekommst du eine Vorahnung wie Akkumulatoren (Akkus) arbeiten.
Gegenüber den Primärbatterien haben die wiederaufladbaren Batterien (Sekundärbatterien) oder Akkumulatoren (kurz: Akkus) erheblich an Bedeutung gewonnen. Sie werden in Autos, Handys, Discman usw. in vielfältiger Form eingesetzt. Am Beispiel des weit verbreiteten Bleiakkus beim Auto soll das Prinzip dieser wiederaufladbaren Energiequellen erläutert werden.
Genau wie bei der Zink-Kohle-Batterie kommt es zur Spannung zwischen den Elektroden, wenn diese verschiedenartig sind und sich ein Elektrolyt zwischen ihnen befindet.
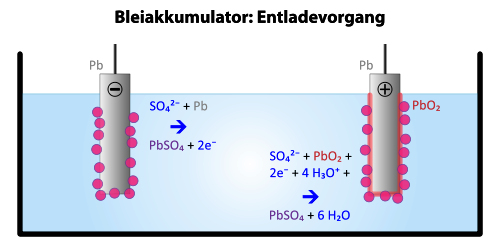
Entladen des Bleiakkus
Bei neuen Bleiakkus sind die Elektroden bereits verschieden. Eine besteht aus Blei (Minuspol) und eine aus Bleioxid (Pluspol). Als Elektrolyt verwendet man verdünnte Schwefelsäure.
| Vorgang am Minuspol | Vorgang am Pluspol |
| \[{\rm{Pb + S}}{{\rm{O}}_{\rm{4}}}^{ - - } \to {\rm{PbS}}{{\rm{O}}_{\rm{4}}}{\rm{ + 2}}{{\rm{e}}^{\rm{ - }}}\]Am Minuspol wird Blei in Bleisulfat umgewandelt. | \[{\rm{Pb}}{{\rm{O}}_{\rm{2}}}{\rm{ + 4}}{{\rm{H}}^{\rm{ + }}}{\rm{ + S}}{{\rm{O}}_{\rm{4}}}^{{\rm{ - - }}}{\rm{ + 2}}{{\rm{e}}^{\rm{ - }}} \to {\rm{ PbS}}{{\rm{O}}_{\rm{4}}}{\rm{ + 2}}{{\rm{H}}_{\rm{2}}}{\rm{O}}\]Am Pluspol wird Bleioxid in Bleisulfat umgewandelt. |
| Gesamtreaktion beim Entladevorgang | |
| \[{\rm{Pb + Pb}}{{\rm{O}}_{\rm{2}}}{\rm{ + 2}}{{\rm{H}}_{\rm{2}}}{\rm{S}}{{\rm{O}}_{\rm{4}}} \to {\rm{ 2PbS}}{{\rm{O}}_{\rm{4}}}{\rm{ + 2}}{{\rm{H}}_{\rm{2}}}{\rm{O + Energie}}\] | |
Laden des Bleiakkus
Wenn die beiden Elektroden chemisch gleichartig geworden sind besteht zwischen ihnen keine Spannung mehr. Schließt man die Anordnung an eine äußere Spannungsquelle (Minuspol der Quelle an Minuspol des Akkus), so werden die chemischen Vorgänge, die bei der Entladung des Akkus abgelaufen sind umgekehrt.
| Vorgang am Minuspol | Vorgang am Pluspol |
| \[{\rm{PbS}}{{\rm{O}}_{\rm{4}}}{\rm{ + 2}}{{\rm{e}}^{\rm{ - }}} \to {\rm{Pb + S}}{{\rm{O}}_{\rm{4}}}^{{\rm{ - - }}}\]Am Minuspol wird Bleisulfat in Blei umgewandelt. | \[{\rm{PbS}}{{\rm{O}}_{\rm{4}}}{\rm{ + 2}}{{\rm{H}}_{\rm{2}}}{\rm{O}} \to {\rm{Pb}}{{\rm{O}}_{\rm{2}}}{\rm{ + 4}}{{\rm{H}}^{\rm{ + }}}{\rm{ + S}}{{\rm{O}}_{\rm{4}}}^{{\rm{ - - }}}{\rm{ + 2}}{{\rm{e}}^{\rm{ - }}}\]Am Pluspol wird Bleisulfat in Bleioxid umgewandelt. |
| Gesamtreaktion beim Ladevorgang | |
| \[{\rm{2PbS}}{{\rm{O}}_{\rm{4}}}{\rm{ + 2}}{{\rm{H}}_{\rm{2}}}{\rm{O + Energie}} \to {\rm{Pb + Pb}}{{\rm{O}}_{\rm{2}}}{\rm{ + 2}}{{\rm{H}}_{\rm{2}}}{\rm{S}}{{\rm{O}}_{\rm{4}}}\] | |
Hinweise
- Eine Bleiakkuzelle hat im geladenen Zustand etwa die Spannung von 2V.
- Ein Bleiakku hat einen relativ geringen Innenwiderstand, ist daher sehr hoch belastbar (vgl. hierzu spätere Kapitel).
- Der Energiewirkungsgrad des Bleiakkus (Verhältnis von elektrischer Energie bei Entladung zu elektrischer Energie bei Ladung) beträgt ca. 80%.
- Dem Nachteil des hohen Gewichtes steht der Vorteil des relativ geringen Preises gegenüber.
- Leichtere wiederaufladbare Batterie, die in tragbaren Geräten eingesetzt werden, sind die sogenannten Lithiumakkus.
Die folgende Abbildung zeigt den Aufbau eines kommerziellen Bleiakkus.
- Zwei Sätze von parallelgeschalteten Gitterplatten sind ineinandergeschoben. Ein Plattensatz ist mit Blei gefüllt, der andere mit Bleioxid.
- Zur Vermeidung von Kurzschlüssen sind zwischen den Platten säurefeste, mikroporöse Seperatoren aus Kunststoff angebracht.