|
Das von Dalton entwickelte Masse-Kugel-Modell konnte keinerlei elektrophysikalische oder elektrochemische Erscheinungen erklären. Bereits im Jahre 1881 zog Helmholtz aus den faradayschen Gesetzen der Elektrolyse und aus Versuchen mit Elektronen- und Ionenstrahlen den Schluss, dass Atome Träger elektrischer Ladung sind.
von Not Mentioned (First World War.com) [Public domain], via Wikimedia Commons
Während der q/m-Wert positiv geladener Teilchen (Kanalstrahlen) mit der Gasart variiert, treten unabhängig von der Natur des Gases immer negative Korpuskel mit derselben spezifischen Ladung auf (Kathodenstrahlen). Man nannte diese Korpuskel später Elektronen. Außerdem war bekannt, dass beim Glühen von Metallen bzw. beim Bestrahlen von Metallen mit UV-Licht unabhängig von der Metallart Korpuskel austreten, welche die gleiche spezifische Ladung hatten, wie die Kathodenstrahlen. |
|
|
|
|
|
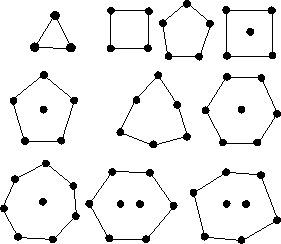
Originalzeichnung von Thomson über die Elektronenanordnung Die zu Thomsons Zeit schon bekannte Periodizität der Elemente wurde durch die verschiedene geometrische Anordnung der Elektronen erklärt. Bei Atomen mit vielen Elektronen musste Thomson aus Stabilitätsgründen mehrere Elektronengruppen annehmen, die man als Vorläufer der später erkannten Elektronenschalen ansehen kann. Beim Thomson-Modell waren die innersten Elektronen für die Eigenschaften des Elements verantwortlich. Dies ist im Gegensatz zur heutigen Auffassung, bei der die äußeren Elektronen die chemischen Eigenschaften des Elements bestimmen. Die Lichtemission der Atome führte Thomson auf Schwingungen des Elektronensystems zurück, die durch äußere Störungen angeregt werden. Wenn Sie an Ausschnitten aus der Originalarbeit von Thomson (das Atommodell betreffend) interessiert sind, dann finden Sie diese hier . |



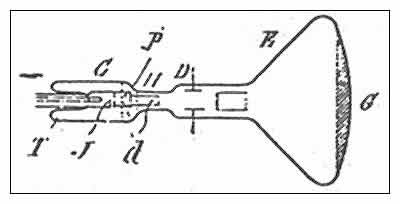 Zur q/m-Bestimmung benutzte Thomson Röhren, bei denen er die geladenen Teilchen durch elektrische und magnetische Felder ablenken konnte.
Zur q/m-Bestimmung benutzte Thomson Röhren, bei denen er die geladenen Teilchen durch elektrische und magnetische Felder ablenken konnte.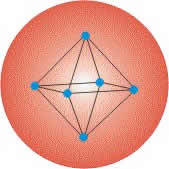 Aus den oben dargestellten Versuchsergebnissen zog Thomson den Schluss, dass die Elektronen elementare Bestandteile aller Atome sind. Damit war es mit der Homogenität und Unstrukturiertheit des Atoms vorbei. Um die Neutralität des Atoms zu wahren, nahm Thomson für das Atom eine Massenkugel an, in der die positive Ladung homogen "verschmiert" ist. In diese Kugel sind dann die Elektronen (ruhend oder bewegt) eingebettet. Man nennt dieses Modell auch "Rosinenkuchen-Modell", da die Elektronen in der homogenen, positiven Ladungsverteilung wie die Rosinen in einem Teig erscheinen. Aus Gründen der Stabilität gelangte Thomson durch Rechnungen zur Forderung, dass die Elektronen regelmäßig angeordnet sein müssten.
Aus den oben dargestellten Versuchsergebnissen zog Thomson den Schluss, dass die Elektronen elementare Bestandteile aller Atome sind. Damit war es mit der Homogenität und Unstrukturiertheit des Atoms vorbei. Um die Neutralität des Atoms zu wahren, nahm Thomson für das Atom eine Massenkugel an, in der die positive Ladung homogen "verschmiert" ist. In diese Kugel sind dann die Elektronen (ruhend oder bewegt) eingebettet. Man nennt dieses Modell auch "Rosinenkuchen-Modell", da die Elektronen in der homogenen, positiven Ladungsverteilung wie die Rosinen in einem Teig erscheinen. Aus Gründen der Stabilität gelangte Thomson durch Rechnungen zur Forderung, dass die Elektronen regelmäßig angeordnet sein müssten.