Im Jahr 1860 gelang es in Heidelberg dem Chemiker Robert Wilhelm BUNSEN (1811-1899) und dem Physiker Gustav Robert KIRCHHOFF (1824-1887), mit einem Prismenspektrometer die Emissionsspektrum von Flammen zu beobachten, die sie mit kleinsten Materialproben gefärbt hatten. Auf diese Weise konnten BUNSEN und KIRCHHOFF die für die jeweiligen Stoffe typischen Linienspektren darstellen. Darüber hinaus gelang es BUNSEN mit diesem Apparat, die bis dahin unbekannten Elemente Cäsium und Rubidium nachzuweisen.
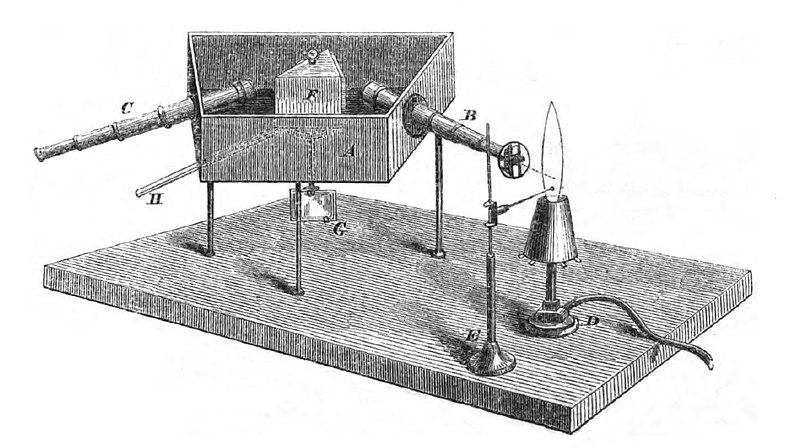
Auf den Träger (E) brachte man den zu untersuchenden Stoff auf und erhitzte diesen mit dem Bunsenbrenner (D). Die für den Stoff typische Lichtemission wurde nun durch den Spektralapparat bestehend aus einem Spalt (S), dem Objektiv (B) und dem Prisma (F) spektral zerlegt und mit dem Fernrohr (C) beobachtet.
BUNSEN und KIRCHHOFF schreiben in der Schrift über die ”Chemische Analyse durch Spektralbeobachtungen" (1860): "Es ist bekannt, dass manche Substanzen die Eigenschaft haben, wenn sie in eine Flamme gebracht werden, in dem Spektrum derselben gewisse helle Linien hervortreten zu lassen. Man kann auf diese Linien eine Methode der qualitativen Analyse gründen, welche das Gebiet der chemischen Reaktionen erheblich erweitert und zur Lösung bisher unzugänglicher Probleme führt. . . . . Die erwähnten Linien zeigen sich um so deutlicher, je höher die Temperatur und je geringer die eigene Leuchtkraft der Flamme ist."
Im Schlusswort schreiben BUNSEN und KIRCHHOFF: "Bietet einerseits die Spektralanalyse ein Mittel von bewunderungswürdiger Einfachheit dar, die kleinsten Spuren gewisser Elemente in irdischen Körpern zu entdecken, so eröffnet sie andererseits der chemischen Forschung ein bisher völlig verschlossenes Gebiet, das weit über die Grenzen der Erde, ja selbst unseres Sonnensystems, hinausreicht. Da es ausreicht, das glühende Gas um dessen Analyse es sich handelt, zu sehen, so liegt der Gedanke nahe, dass dieselbe auch anwendbar sei auf die Atmosphäre der Sonne und die helleren Fixsterne."
Aufbau und Durchführung
- Schalte den Brenner ein.
- Lege das Stäbchen aus der gewünschten Probe in die Halterung ein.
- Beobachte das jeweilige Emissionsspektrum auf dem Monitor. Das Spektrum ist durch Anklicken des Symbols vergrößerbar.
Abb. 3 Flammenspektroskopie (© 2019 Freie Universität Berlin | AG Didaktik der Physik in Zusammenarbeit mit QUA-LiS NRW)
Hinweis: Die Färbung von Flammen durch weitere Elemente findest du z.B. im Artikel Flammenfärbung bei Wikipedia.
Beobachtung
Aufgabe
Beschreibe das grundsätzliche Erscheinungsbild der Spektren.
Vergleiche das jeweilige Spektrum mit der Farbe der zugehörigen Brennerflamme.
Vergleiche die Spektren von Kaliumchlorid (KCl), Natriumchlorid (NaCl) und Lithiumchlorid (LiCl).
Erläutere, welche Aussage man über das Emissionsspektrum von Chlorid treffen kann.
Ergebnis
Je nach eingebrachter Probe ergeben sich die unterschiedlichsten Flammenfärbungen, die einem Fachmann sofort einen ersten Hinweis auf die Art der Probe geben. Für einen genauen Aufschluss muss das Licht der gefärbten Flamme noch spektral zerlegt werden.
Anwendung
Die entsprechenden chemischen Elemente werden in der Praxis z.B. in Feuerwerksraketen eingesetzt, um entsprechende Farbeffekte am Nachthimmel zu erzielen. Auch gibt es inzwischen sog. Feuerfarbenpulver zu kaufen, welches die Flammen eines Lagerfeuers bunt färbt. Aber Achtung: entsprechende Chemikalien sind in der Regel umwelt- und gesundheitsschädlich.
Hinweis: Aufgabenstellungen und Lösungen nach: Flammenspektroskopie (© 2019 Freie Universität Berlin | AG Didaktik der Physik in Zusammenarbeit mit QUA-LiS NRW)