Um Licht genauer zu untersuchen benutzt man Spektralapparate. Dabei handelt es sich um optische Instrumente, mit dem elektromagnetische Strahlung und im besonderen Licht benachbarter Wellenlängenbereiche in seine spektralen Anteile zerlegt, beobachtet und registriert werden kann. Prismen oder Gitter sind bereits einfache Spektralapparate.
Als Ergebnis erhält man auf einem Schirm ein sogenanntes Spektrum. Aus beobachteten Spektren (spectrum (lat.): Erscheinung) kann man vielfältige Informationen über den Aufbau von Atomen gewinnen. Salopp sagt man auch "Das Spektrum ist der Fingerabdruck eines Atoms". Neben den genauen Wellenlängen werden dabei auch die unterschiedlichen Intensitäten der einzelnen Spektrallinien genutzt.
Grundsätzlich unterscheidet man bei Spektren nach der Art ihrer Entstehung zwischen Emissionsspektren und Absorptionsspektren.
Emissionsspektren
Heiße Materialien wie z.B. eine Glühwendel, der Lichtbogen einer Kohlebogenlampe, eine gefärbte Flamme oder das Gas in einer Entladungsröhre senden Licht aus, wir sagen dazu sie emittieren (emittere (lat.): aussenden) Licht. Das Spektrum des emittierten Lichts bezeichnen wir als Emissionsspektrum.
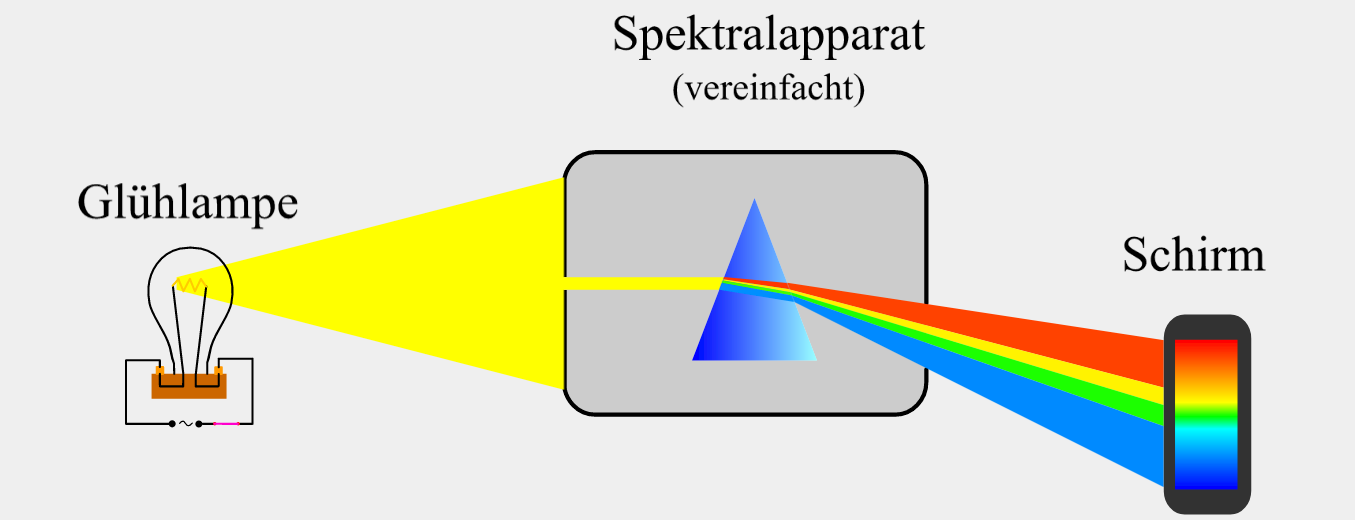
Untersucht man das Licht, das eine Glühlampe, eine Kohlebogenlampe oder die Sonne emittiert, besteht das Emissionsspektrum aus einem durchgehenden farbigem Band, in dem die verschiedenen Farben von rot bis violett nahtlos ineinander übergehen (Abb. 1). Ein solches Spektrum nennt man kontinuierliches Emissionsspektrum (continuus (lat.); zusammenhängend, fortwährend). Glühwendeln aus verschiedenen Materialien zeigen dabei ein annähernd identisches kontinuierliches Emissionsspektrum.
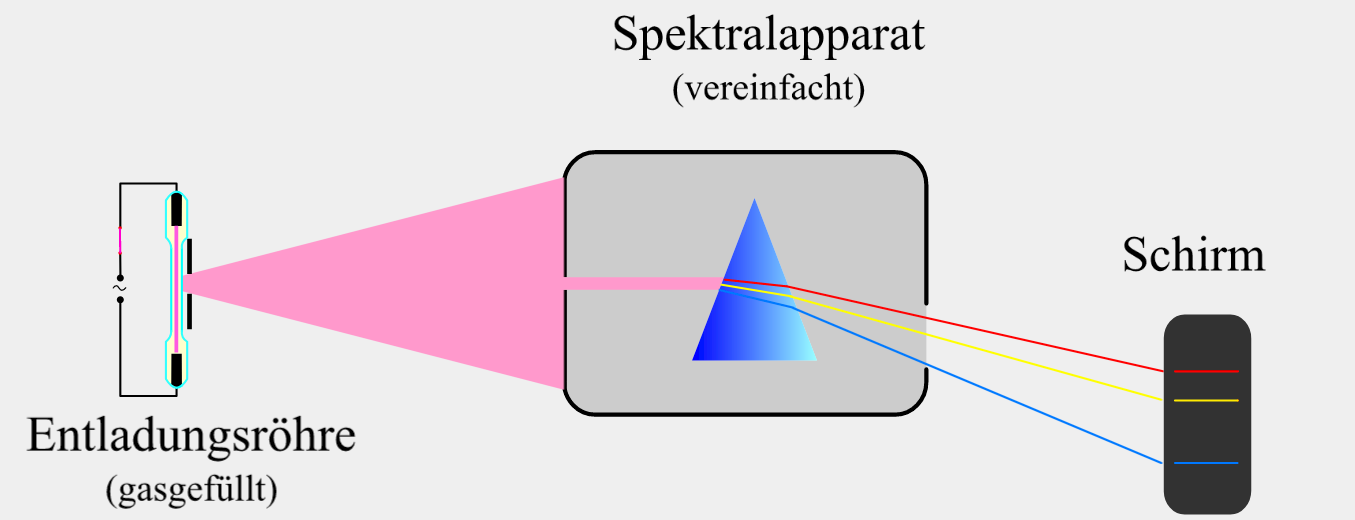
Untersucht man dagegen das Licht, das heißes Gas in einer Entladungsröhre emittiert, besteht das Emissionsspektrum aus mehreren einzelnen farbigen Linien (vgl. Abb. 2). Weil die einzelnen Linien voneinander getrennt sind, nennt man ein solches Emissionspektrum diskretes Emissionsspektrum (discretus (lat.): abgesondert) oder Linienspektrum. Die Positionen bzw. Farben der einzelnen Linien im Spektrum sind dabei charakteristisch für das jeweilige Gas.
Die Animation in Abb. 3 zeigt die diskreten Emissionsspektren verschiedener Elemente sowie das kontinuierliche Spektrum einer Kohlebogenlampe. Dabei werden in der Regel die wichtigsten Linien dargestellt. Die unterschiedlichen Intensitäten der einzelnen Linien ist nicht dargestellt, auch wenn diese teilweise stark variieren.
Hinweis: Eine Datenbank mit der Sammlung aller beobachteten Spektrallinien verschiedener Elemente auch in unterschiedlicher Elektronenkonfiguration findest du in der Atomic Spectra Database.
Absorptionsspektren
Lässt man das "weiße" Licht z.B. einer Kohlebogenlampe durch durchsichtige Gegenstände wie z.B. Glas, Flüssigkeiten oder Gase fallen, so erscheint das ausfallende Licht oft etwas dunkler und in einer anderen Farbe als das einfallende Licht. Wir sagen dazu, die Gegenstände absorbieren (absorbere (lat.): verschlingen) Licht. Das Spektrum des ausfallenden Lichts bezeichnen wir als Absorptionsspektrum.
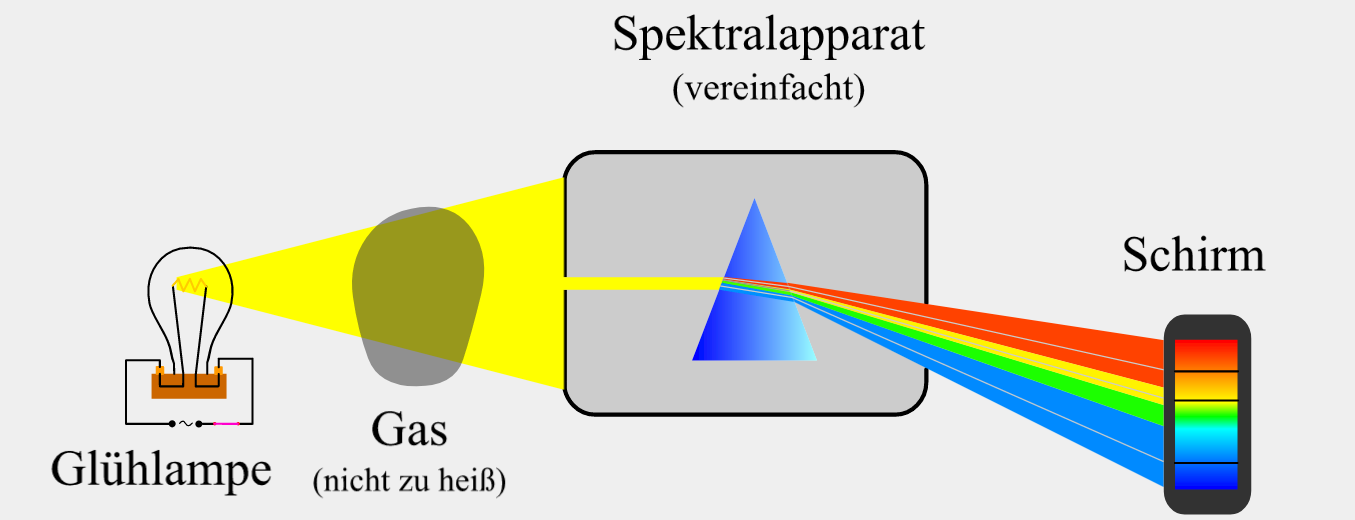
Untersucht man das Licht einer Kohlebogenlampe, nachdem es ein (nicht zu) heißes Gas durchquert hat, so besteht das Spektrum aus einem durchgehenden farbigem Band mit einzelnen dunklen Linien (Abb. 4). Im kontinuierlichen Spektrum der Kohlebogenlampe fehlen also einzelne Farben. Die einzelnen dunklen Linien nennen wir Absorptionslinien. Die Positionen der einzelnen Absorptionslinien im Spektrum sind dabei charakteristisch für das jeweilige Gas.
Die Animation in Abb. 5 zeigt die diskreten Emissionsspektren verschiedener Elemente sowie das kontinuierliche Spektrum einer Kohlebogenlampe. Dabei werden in der Regel die wichtigsten Linien dargestellt. Die unterschiedlichen Intensitäten der einzelnen Linien ist nicht dargestellt, auch wenn diese teilweise stark variieren.
Hinweis: Eine Datenbank mit der Sammlung aller beobachteten Spektrallinien verschiedener Elemente auch in unterschiedlicher Elektronenkonfiguration findest du in der Atomic Spectra Database.
Spektrum nicht nur im sichtbaren Bereich
Strahlt man das kontinuierliche Spektrum einer Glüh- oder Kohlebogenlampe anstatt auf einen normalen Schirm auf einen Zink-Sulfid-Schirm, so beginnt dieser im violetten Bereich und auch darüber hinaus zu leuchten. Das Spektrum besteht also nicht nur aus sichtbaren, sondern auch aus nicht sichtbaren Anteilen. Ultraviolette Strahlung (UV-Strahlung) sorgt dafür, dass der Zink-Sulfid-Schirm zu leuchten beginnt.
Anwendung
Mithilfe einer Spektralanalyse kann man die chemische Zusammensetzung von Lichtquellen untersuchen, ohne Zugang zu der Lichtquelle haben zu müssen. Dies wird z.B. von Astronomen genutzt, um die Zusammensetzung weit entfernter Sterne zu bestimmen.